กราไฟต์ สูตรโมเลกุล: C น้ำหนักโมเลกุล: 12.01 เป็นรูปแบบหนึ่งของธาตุคาร์บอน โดยอะตอมของคาร์บอนแต่ละอะตอมเชื่อมต่อกันด้วยอะตอมของคาร์บอนอีกสามอะตอม (จัดเรียงเป็นรูปหกเหลี่ยมรังผึ้ง) เพื่อสร้างโมเลกุลโควาเลนต์ เนื่องจากอะตอมของคาร์บอนแต่ละอะตอมปล่อยอิเล็กตรอนออกมา 1 ตัว ซึ่งเป็นอิเล็กตรอนที่สามารถเคลื่อนที่ได้อย่างอิสระ กราไฟต์จึงเป็นตัวนำ
กราไฟต์เป็นแร่ธาตุที่อ่อนที่สุดชนิดหนึ่ง และนำไปใช้ประโยชน์ได้หลายอย่าง เช่น การทำไส้ดินสอและสารหล่อลื่น คาร์บอนเป็นองค์ประกอบที่ไม่ใช่โลหะที่อยู่ในกลุ่ม IVA รอบที่สองของตารางธาตุ กราไฟท์เกิดขึ้นที่อุณหภูมิสูง
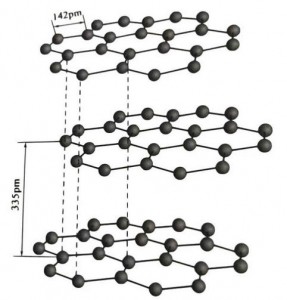
กราไฟต์เป็นแร่ผลึกขององค์ประกอบคาร์บอน และตาข่ายผลึกของมันคือโครงสร้างชั้นหกเหลี่ยม ระยะห่างระหว่างแต่ละชั้นตาข่ายคือ 3.35A และระยะห่างของอะตอมคาร์บอนในชั้นตาข่ายเดียวกันคือ 1.42A มันเป็นระบบคริสตัลหกเหลี่ยมที่มีความแตกแยกเป็นชั้นที่สมบูรณ์ พื้นผิวที่แตกแยกส่วนใหญ่เป็นพันธะโมเลกุล ซึ่งมีความน่าดึงดูดน้อยกว่าโมเลกุล ดังนั้นการลอยตัวตามธรรมชาติจึงดีมาก
ในผลึกกราไฟท์ อะตอมของคาร์บอนในชั้นเดียวกันจะเกิดพันธะโควาเลนต์โดยมี sp2 ไฮบริดไดเซชัน และอะตอมของคาร์บอนแต่ละอะตอมจะเชื่อมต่อกับอะตอมอื่นอีกสามอะตอมในพันธะโควาเลนต์สามพันธะ อะตอมของคาร์บอนทั้ง 6 อะตอมก่อตัวเป็นวงแหวนที่ต่อเนื่องกัน 6 วงในระนาบเดียวกัน ขยายออกเป็นโครงสร้างลาเมลลา โดยที่ความยาวพันธะของพันธะ CC อยู่ที่ 142pm ซึ่งอยู่ภายในช่วงความยาวพันธะของผลึกอะตอมพอดี ดังนั้นสำหรับชั้นเดียวกัน มันคือผลึกอะตอม อะตอมของคาร์บอนในระนาบเดียวกันมีวงโคจร p หนึ่งวงซึ่งทับซ้อนกัน อิเล็กตรอนค่อนข้างอิสระ เทียบเท่ากับอิเล็กตรอนอิสระในโลหะ ดังนั้นกราไฟต์จึงสามารถนำความร้อนและไฟฟ้าได้ ซึ่งเป็นลักษณะเฉพาะของผลึกโลหะ จึงจัดเป็นผลึกโลหะด้วย
ชั้นกลางของคริสตัลกราไฟท์จะถูกแยกออกจากกันในเวลา 15.35 น. และมีระยะห่างมาก มันรวมกับแรงแวนเดอร์วาลส์นั่นคือชั้นเป็นของผลึกโมเลกุล อย่างไรก็ตาม เนื่องจากการจับกันของอะตอมของคาร์บอนในชั้นระนาบเดียวกันนั้นมีความแข็งแรงมากและยากต่อการทำลายอย่างยิ่ง จุดละลายของกราไฟท์จึงสูงมากเช่นกัน และคุณสมบัติทางเคมีของกราไฟท์จึงมีความเสถียร
เมื่อพิจารณาถึงโหมดการยึดเกาะแบบพิเศษ จึงไม่ถือเป็นผลึกเดี่ยวหรือโพลีคริสตัล โดยทั่วไปแล้วกราไฟท์จะถือเป็นคริสตัลผสม
เวลาโพสต์: Jul-31-2023